医の倫理の基礎知識 2018年版
【人を対象とする研究】H-6.再生医療の発展と法的規制―再生医療等安全性確保法について
飛田 護邦(順天堂大学革新的医療技術開発センター准教授)
1.再生医療の法的規制
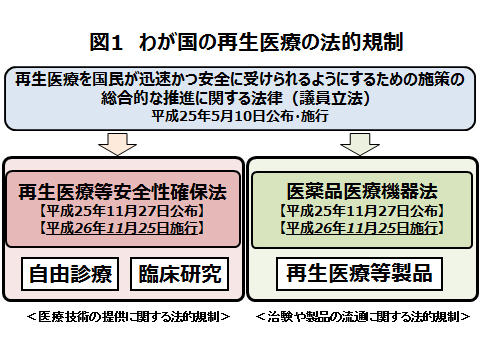
わが国の再生医療を推進するため、平成25年5月に、再生医療を国民が迅速かつ安全に受けられるようにするための施策の総合的な推進に関する法律(平成25年法律第13号)が公布、施行された。この法律をもとに、平成26年11月に再生医療等の安全性の確保等に関する法律(平成25年法律第85号、以下、再生医療等安全性確保法)と、薬事法等の一部を改正する法律が施行された。再生医療等安全性確保法は、再生医療等の迅速かつ安全な提供や普及の促進を図ることを目的としており、再生医療等を臨床研究や自由診療として行う場合は、再生医療等安全性確保法の対象となる。なお、平成29年4月には、臨床研究法(平成29年法律第16号)が公布されたが、再生医療等安全性確保法の対象となる臨床研究は、臨床研究法の適用除外となり、引き続き、再生医療等安全性確保法を遵守しなくてはならない(図1)。
再生医療等安全性確保法は、医療機関が再生医療等を提供しようとするときに遵守しなければならない事項を定めたものであり、再生医療等安全性確保法の対象となる再生医療等は、医療のリスクに応じて第1種、第2種、第3種再生医療等技術に分類される。どのリスク区分に分類された場合であっても、厚生労働省または地方厚生局へ再生医療等提供計画の提出が必要であり、再生医療等提供計画は厚生労働省へ提出する前に、第1種および第2種再生医療等については特定認定再生医療等委員会の、第3種再生医療等については認定再生医療等委員会の意見を聞くことが必要となる。リスク分類については、第1種再生医療等には、iPS細胞や遺伝子を導入する操作を行った細胞を用いるもの、投与を受ける者以外の人の細胞を用いるもの等が該当する。第2種再生医療等には、培養した幹細胞を利用したもの等が該当する。第3種再生医療等には、癌免疫治療にリンパ球を用いるもの等が該当する。その他、本法の施行に伴い、細胞の加工を行う場合は細胞培養加工施設の構造設備基準等を遵守する必要があり、外部委託をする場合だけでなく、医療機関内で細胞の加工を行う際にもこの基準は適用される。
2.わが国における再生医療の現状
平成29年10月末時点において、再生医療等安全性確保法の下で提供されている再生医療の実施状況は、第1種再生医療等は17件(治療:0件、研究:17件)、第2種再生医療等は176件(治療:119件、研究:57件)、第3種再生医療等は3,517件(治療:3,461件、研究:56件)である。また、医療機関内に存在する細胞培養加工施設(届出)は2,478施設、医療機関外に存在する細胞培養加工施設(許可申請)は58施設、国外に存在する細胞培養加工施設(認定申請)は6施設存在している。認定された再生医療等委員会については、特定認定再生医療等委員会が49、認定再生医療等委員会(第3種のみ審査)が103の機関等に設置されている。
3.再生医療等安全性確保法の今後の課題
再生医療等安全性確保法施行後3年が過ぎ、わが国における再生医療の実態が明らかとなる一方で、再生医療等安全性確保法に該当する再生医療等が国に無届で提供されるなど、再生医療等を提供する医師等が有すべき法令遵守の意識が社会問題となってきた。
同時に、再生医療等を受けようとする患者へ十分な情報と適切な医療を提供していくためには、創出される再生医療等技術を審査する委員会の審査レベルを如何に向上していくかについても重要な課題といえる。さらに再生医療等安全性確保法下において医療(保険外診療)として提供されている再生医療等技術のあり方についての議論が必要であろう。海外においても、エビデンスの乏しい細胞治療が提供されることへの懸念が示されているなか、再生医療等を医療として提供する前に、日本人に対する十分な検証が実施されているとは言い難いのではないだろうか。われわれは、再生医療等安全性確保法が施行されるに至った経緯を今一度考え、再生医療等安全性確保法下の臨床研究において検証した医療技術を医療へとつなげていく道筋を築き上げていくべきであろう。
(平成30年8月31日掲載)
目次
【医師の基本的責務】
【医師と患者】
【終末期医療】
【生殖医療】
【遺伝子をめぐる課題】
【医師とその他の医療関係者】
【医師と社会】
【人を対象とする研究】
